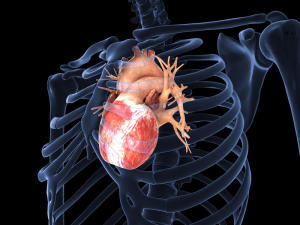
بافت قلب در یک حملهی قلبی متحمّل آسیبهای جبرانناپذیری میشود. چون سلولهای قلبی توانایی تکثیر ندارند و تعداد اندکی سلول بنیادی در قلب وجود دارد، این بافت قابلیّت ترمیم خود را ندارد؛ در نتیجه دچار فیبروزیس میشود و نمیتواند بهخوبی منقبض شود.
دانشمندان درپی یافتن شیوههای جدید برای بازیابی عمل قلب، به دنبال یافتن «پچ»های قلبی بودند که بتواند به بدن بیمار پیوندزدهشود و جایگزین بافت آسیبدیدهی قلب شود.
دکتر Tal Dvir و دانشجوی دورهی Phd او، Michal Shevach، با کمک همکارانشان در دپارتمان میکروبیولوژی مولکولی و بیوتکنولوژی و مرکز نانوساینس و نانوتکنولوژی از دانشگاه Tel Aviv، آغاز به بهکارگیری طلا درمهندسی بافت قلبی کردند.
آنها در رویارویی با بزرگترین چالشِ ساخت پچهای قلبی، یعنی اطمینان از هماهنگی سیستم الکتریکی قلب که زنش قلب و ریتم آن را کنترلمیکند، سلولهای قلبی را با نانوفیبرهایی از جنس ذرّات طلا ادغامکردند. هدف آنها بهبود پیامرسانی الکتریکی در بین سلولهای قلبی بود.
Dvir میگوید:«طلا در افزایش اتّصال بیومتریالها مؤثّر شناختهشدهاست. با افزودن طلا به بافت قلبی، این بافت سریعتر، قویتر و هماهنگتر از قبل منقبض شد.» این پژوهش در مجلّهی Materials Chemistry B منتشر شد.
دادن دست کمک به طبیعت
Dvir میگوید:«سلولهای قلبی در سطح خود دارای پروتئینهایی هستند که مسئول انتقال سیگنالهای الکتریکی هستند. امّا فرایند مهندسی بافت قلبی خود سبب نابودی این پروتئینها میشود. سلولها بهطور طبیعی شروع به ساخت دوبارهی این پروتئینها میکنند. امّا این کار نیازمند زمان است که شاید بیمار فرصت این بازسازی را نداشتهباشد. نانوفیبرهای طلا میتوانند نقش این پروتئینها را تا زمانی که سلول آنها را بازسازیکند، بازیکنند.»
بافتهای جدید با قرار دادن سلولهای بیمار یا یک حیوان در یک قالب سهبعدی ساختهشده از بیومتریالها (هر مادّه یا سطحی که با سیستمهای بیولوژیک برهمکنش داشتهباشد) ساختهمیشوند که سبب شکل مناسب بافت به هنگام رشد این سلولها میشود. Dvir و تیمش به کمک روشهای شیمیایی و فیزیکی ذرّاتی از جنس طلا را وارد قلب کردند. سرانجام این سلولها با کمک ذرّات طلا توانایی خود در انتقال سیگنالهای الکتریکی را بازیافتند.
پژوهشگران با به کارگیری میکروسکوپهای الکترونی نگاره (SEM) و سنجشهای گوناگون الکتریکی، رسانایی الکتریکی این بافت جدید را سنجیدند. سلولهایی که در قالبِ دارای ذرّات طلا قرارداشتند، دارای انقباضهای قویتری نسبت به سلولهایی بودند که در قالب بدون ذرّات طلا قرارداشتند. همچنین انقباض یکپارچهی این سلولها اثباتی بر پیامرسانی الکتریکی مناسب بین آنها بود.
یک شانس طلایی
چون ۵۰٪ قربانیان حملهی قلبی پس از گذشت ۵ سال از نخستین حمله، جان خود را ازدستمیدهند، نیاز به گزینههای درمانی جدید به شدّت احساس میشود. یک بافت قلبی قابل پیوند و کارا نه تنها جان بیماران را حفظمیکند، بلکه بر کیفیت زندگی آنان میافزاید.
Dvir افزود:«برای اثبات ظرفیت پیامرسانی الکتریکی این پچهای قلبی دارای نانوفیبر طلا، انجام آزمایشهای آزمایشگاهی و سپس آزمونهای کلینیکی بر روی بیماران ضروری است. روش ایدهآل برای ساخت این بافتها استفاده از سلولهای خود بیمار است، چون احتمال موفّقیّت را افزایشمیدهد.»
بنمایه
 شاید به زودی شناسایی بوی بدن از دیگر روشهای بیومتریکِ شناسایی مانند تشخیص چهره، اسکن اثرانگشت و عنبیه، پیشیبگیرد. پژوهشگران در دانشگاه Spain’s Universidad Politecnica de Madrid با همکاری شرکت IIia Sistemas SL درحال توسعهی سیستمی هستند که بتواند انسانها را با بوی بدنشان از هم بازشناسد.
شاید به زودی شناسایی بوی بدن از دیگر روشهای بیومتریکِ شناسایی مانند تشخیص چهره، اسکن اثرانگشت و عنبیه، پیشیبگیرد. پژوهشگران در دانشگاه Spain’s Universidad Politecnica de Madrid با همکاری شرکت IIia Sistemas SL درحال توسعهی سیستمی هستند که بتواند انسانها را با بوی بدنشان از هم بازشناسد.
 دانشمندان در آزمایشگاه ملّی Lawrence Berkeley مدلهایی از جنین موش تهیّهکردند تا چگونگی بیان ژنها را در بخشهای گوناگون بدنِ درحال تکوین بررسیکنند. آنها دریافتند که توالیهای کوچکی از DNA که به پروتئین کُدنمیشوند و اصطلاحاً
دانشمندان در آزمایشگاه ملّی Lawrence Berkeley مدلهایی از جنین موش تهیّهکردند تا چگونگی بیان ژنها را در بخشهای گوناگون بدنِ درحال تکوین بررسیکنند. آنها دریافتند که توالیهای کوچکی از DNA که به پروتئین کُدنمیشوند و اصطلاحاً